Для преобразования энергии, заключенной в жирных кислотах, в энергию связей АТФ существует метаболический путь окисления жирных кислот до СО 2 и воды, тесно связанный с циклом трикарбоновых кислот и дыхательной цепью. Этот путь называется β-окисление , т.к. происходит окисление 3-го углеродного атома жирной кислоты (β-положение) в карбоксильную группу, одновременно от кислоты отщепляется ацетильная группа, включающая С 1 и С 2 исходной жирной кислоты.
Элементарная схема β-окисления
Реакции β-окисления происходят в митохондриях большинства клеток организма (кроме нервных клеток). Для окисления используются жирные кислоты, поступающие в цитозоль из крови или появляющиеся при липолизе собственных внутриклеточных ТАГ. Суммарное уравнение окисления пальмитиновой кислоты выглядит следующим образом:
Пальмитоил-SКоА + 7ФАД + 7НАД + + 7Н 2 O + 7HS-KoA → 8Ацетил-SКоА + 7ФАДН 2 + 7НАДН
Этапы окисления жирных кислот
1. Прежде, чем проникнуть в матрикс митохондрий и окислиться, жирная кислота должна активироваться в цитозоле. Это осуществляется присоединением к ней коэнзима А с образованием ацил-SКоА. Ацил-SКоА является высокоэнергетическим соединением. Необратимость реакции достигается гидролизом дифосфата на две молекулы фосфорной кислоты.
Ацил-SКоА-синтетазы находятся в эндоплазматическом ретикулуме, на наружной мембране митохондрий и внутри них. Существует широкий ряд синтетаз, специфичных к разным жирным кислотам.
Реакция активации жирной кислоты
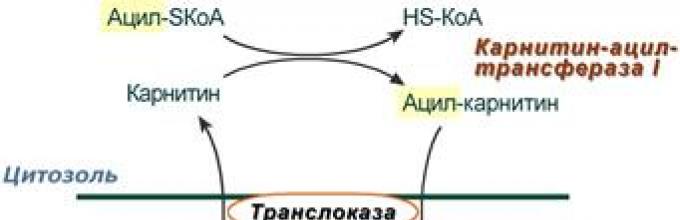
2. Ацил-SКоА не способен проходить через митохондриальную мембрану, поэтому существует способ его переноса в комплексе с витаминоподобным веществом карнитином . На наружной мембране митохондрий имеется фермент карнитин-ацилтрансфераза I .

Карнитин-зависимый транспорт жирных кислот в митохондрию
Карнитин синтезируется в печени и почках и затем транспортируется в остальные органы. Во внутриутробном периоде и в первые годы жизни значение карнитина для организма чрезвычайно велико. Энергообеспечение нервной системы детского организма и, в частности, головного мозга осуществляется за счет двух параллельных процессов: карнитин-зависимого окисления жирных кислот и аэробного окисления глюкозы. Карнитин необходим для роста головного и спинного мозга, для взаимодействия всех отделов нервной системы, ответственных за движение и взаимодействие мышц. Существуют исследования, связывающие с недостатком карнитина детский церебральный паралич и феномен "смерти в колыбели ".
Дети раннего возраста, недоношенные и дети с малой массой особен-но чувствительны к недостаточности карнитина. Эндогенные запасы у них быстро истощаются при различных стрессовых ситуациях (инфекционные заболевания, желудочно-кишечные расстройства, нарушения вскармливания). Биосинтез карнитина резко ограничен в связи с небольшой мышечной массой, а поступление с обычными пищевыми продуктами неспособно поддержать достаточный уровень в крови и тканях.
3. После связывания с карнитином жирная кислота переносится через мембрану транслоказой . Здесь на внутренней стороне мембраны фермент карнитин-ацилтрансфераза II вновь образует ацил-SКоА который вступает на путь β-окисления.
4. Процесс собственно β-окисления состоит из 4-х реакций, повторяющихся циклически. В них последовательно происходит окисление (ацил-SКоА-дегидрогеназа), гидратирование (еноил-SКоА-гидратаза) и вновь окисление 3-го атома углерода (гидроксиацил-SКоА-дегидрогеназа). В последней, трансферазной, реакции от жирной кислоты отщепляется ацетил-SКоА . К оставшейся (укороченной на два углерода) жирной кислоте присоединяется HS-КоА, и она возвращается к первой реакции. Все повторяется до тех пор, пока в последнем цикле не образуются два ацетил-SКоА.

Последовательность реакций β-окисления жирных кислот
Расчет энергетического баланса β-окисления
Ранее при расчете эффективности окисления коэффициент P/O для НАДH принимался равным 3,0, для ФАДH 2 – 2,0.
По современным данным значение коэффициента P/O для НАДH соответствует 2,5, для ФАДH 2 – 1,5.
При расчете количества АТФ, образуемого при β-окислении жирных кислот необходимо учитывать:
- количество образуемого ацетил-SКоА – определяется обычным делением числа атомов углерода в жирной кислоте на 2.
- число циклов β-окисления . Число циклов β-окисления легко определить исходя из представления о жирной кислоте как о цепочке двухуглеродных звеньев. Число разрывов между звеньями соответствует числу циклов β-окисления. Эту же величину можно подсчитать по формуле (n/2 -1), где n – число атомов углерода в кислоте.
- число двойных связей в жирной кислоте. В первой реакции β-окисления происходит образование двойной связи при участии ФАД. Если двойная связь в жирной кислоте уже имеется, то необходимость в этой реакции отпадает и ФАДН 2 не образуется. Количество недополученных ФАДН 2 соответствует числу двойных связей. Остальные реакции цикла идут без изменений.
- количество энергии АТФ , потраченной на активацию (всегда соответствует двум макроэргическим связям).
Пример. Окисление пальмитиновой кислоты
- так как имеется 16 атомов углерода, то при β-окислении образуется 8 молекул ацетил-SКоА . Последний поступает в ЦТК, при его окислении в одном обороте цикла образуется 3 молекулы НАДН (7,5 АТФ), 1 молекула ФАДН 2 (1,5 АТФ) и 1 молекула ГТФ, что эквивалентно 10 молекулам АТФ. Итак, 8 молекул ацетил-SКоА обеспечат образование 8×10=80 молекул АТФ.
- для пальмитиновой кислоты число циклов β-окисления равно 7 . В каждом цикле образуется 1 молекула ФАДН 2 (1,5 АТФ) и 1 молекула НАДН (2,5 АТФ). Поступая в дыхательную цепь, в сумме они "дадут" 4 молекулы АТФ. Таким образом, в 7 циклах образуется 7×4=28 молекул АТФ.
- двойных связей в пальмитиновой кислоте нет .
- на активацию жирной кислоты идет 1 молекула АТФ, которая, однако, гидролизуется до АМФ, то есть тратятся 2 макроэргические связи или две АТФ .
Таким образом, суммируя, получаем 80+28-2 =106 молекул АТФ образуется при окислении пальмитиновой кислоты.
Биологическое окисление жирных кислот можно сопоставить со сгоранием углеводородов: как в одном, так и в другом случае наблюдается наибольший выход свободной энергии. При биологическом b-окислении углеводородной части жирных кислот образуются двууглеродные активированные компоненты, доокисляющиеся в ЦТК, и большое количество восстановительных эквивалентов, которые приводят к синтезу АТР в дыхательной цепи. Большинство аэробных клеток способно к полному окислению жирных кислот до углекислого газа и воды.
Источником жирных кислот служат экзогенные или эндогенные липиды. Последние чаще всего представлены триацилглицеридами, которые откладываются в клетках в качестве резервного источника энергии и углерода. Кроме этого, клетки используют и полярные липиды мембран, метаболическое обновление которых происходит постоянно. Липиды расщепляются с помощью специфических ферментов (липазы) до глицерола и свободных жирных кислот.
b-окисление жирных кислот . Этот основной процесс окисления жирных кислот осуществляется у эукариот в митохондриях. Переносу жирных кислот через мембраны митохондрий способствует карнитин (g-триметиламино-b-оксибутират), который связывает молекулу жирной кислоты особым образом, в результате чего положительный (на атоме азота) и отрицательный (на атоме кислорода карбоксильной группы) заряды оказываются сближенными и нейтрализуют друг друга.
После транспорта в матрикс митохондрий жирные кислоты подвергаются активации с помощью СоА в АТР-зависимой реакции, которую катализирует ацетат-тиокиназа (рис. 9.1). Затем ацил-СоА-производное окисляется с участием ацил-дегидрогеназы. В клетке существует несколько разных ацилдегидрогеназ, специфичных к СоА-производным жирных кислот с разной длиной углеводородной цепи. Все эти ферменты используют FAD в качестве простетической группы. Образующийся в реакции FADH 2 в составе ацилдегидрогеназы окисляется другим флавопротеидом, переносящим электроны к дыхательной цепи в составе митохондриальной мембраны.
Продукт окисления - еноил-СоА гидратируется под действием еноилгидратазы с образованием b-гидроксиацил-СоА (рис. 9.1). Существуют еноил-СоА-гидратазы, специфичные к цис- и транс-формам еноил-СоА-производных жирных кислот. При этом транс-еноил-СоА гидратируется стереоспецифически в L-b-гидроксиацил-СоА, а цис-изомеры - в D-стереоизомеры -b-гидроксиацил-СоА-эфиров.
Последний этап реакций b-окисления жирных кислот представляет собой дегидрирование L-b-гидроксиацил-СоА (рис. 9.1). Окислению подвергается b-углеродный атом молекулы, поэтому и весь процесс носит название b-окисления. Катализирует реакцию b-гидроксиацил-СоА-дегидрогеназа, специфичная только к L-формам b-гидроксиацил-СоА. Этот фермент использует в качестве кофермента NAD. Дегидрирование D-изомеров b-гидроксиацилСоА осуществляется после дополнительной стадии изомеризации их в L-b-гидроксиацил-СоА (фермент b-гид-роксиацил-СоА-эпимераза). Продукт данного этапа реакций представляет собой b-кетоацил-СоА, легко расщепляющийся тиолазой на 2 производных: ацил-СоА, который короче исходного активированного субстрата на 2 углеродных атома, и ацетил-СоА-двууглеродный компонент, отщепленный от жирнокислотной цепи (рис. 9.1). Ацил-СоА-производное подвергается следующему циклу реакций b-окисления, а ацетил-СоА может вступать в цикл трикарбоновых кислот для дальнейшего окисления.
Таким образом, каждый цикл b-окисления жирных кислот сопровождается отщеплением от субстрата двууглеродного фрагмента (ацетил-СоА) и двух пар атомов водорода, восстанавливающих 1 молекулу NAD + и одну молекулу FAD. Процесс продолжается до полного расщепления жирнокислотной цепи. Если жирная кислота состояла из нечетного числа атомов углерода, то b-окисление завершается образованием пропионил-СоА, который в ходе нескольких реакций превращается в сукцинил-СоА и в таком виде может вступать в ЦТК.
Большинство жирных кислот, входящих в состав клеток животных, растений и микроорганизмов, содержит неразветвленные углеводородные цепи. В то же время в липидах некоторых микроорганизмов и в восках растений присутствуют жирные кислоты, чьи углеводородные радикалы имеют точки ветвления (обычно в виде метильных групп). Если ветвлений немного, и все они приходятся на четные положения (у углеродных атомов 2, 4 и т. д.), то процесс b-окисления происходит по обычной схеме с образованием ацетил- и пропионил-СоА. Если же метильные группы расположены у нечетных атомов углерода, процесс b-окисления блокируется на стадии гидратирования. Это следует учитывать при производстве синтетических детергентов: чтобы обеспечить их быструю и полную биодеградацию в окружающей среде, надо к массовому потреблению допускать лишь варианты с неразветвленными углеводородными цепями.
Окисление ненасыщенных жирных кислот . Этот процесс осуществляется с соблюдением всех закономерностей b-окисления. Однако большинство природных ненасыщенных жирных кислот имеет двойные связи в таких местах углеводородной цепи, что последовательное удаление двууглеродных фрагментов с карбоксильного конца дает ацил-СоА-производное, у которого двойная связь находится в положении 3-4. К тому же двойные связи природных жирных кислот имеют цис-конфигурацию. Чтобы смогла осуществиться стадия дегидрирования с участием b-гидроксиацил-СоА-дегидрогеназы, специфичной к L-формам b-гидроксиацил-СоА, необходима дополнительная стадия ферментативной изомеризации, в ходе которой двойная связь в молекуле СоА-производного жирной кислоты перемещается из положения 3-4 в положение 2-3 и изменяется конфигурация двойной связи из цис- в транс-. Такой метаболит служит субстратом еноил-гидратазы, превращающей транс-еноил-СоА в L-b-гидроксиацил-СоА.
В тех случаях, когда перенос и изомеризация двойной связи оказываются невозможными, такая связь восстанавливается при участии NADPH. Последующая деградация жирной кислоты происходит по обычному механизму b-окисления.
Второстепенные пути окисления жирных кислот . b-Окисление представляет собой основной, но не единственный путь катаболизма жирных кислот. Так, в клетках растений обнаружен процесс a-окисления жирных кислот, содержащих в составе 15- 18 атомов углерода. Этот путь включает первичную атаку жирной кислоты пероксидазой в присутствии перекиси водорода, в результате чего карбоксильный углерод отщепляется в виде СО 2 , а атом углерода в a-положении окисляется до альдегидной группы. Затем альдегид окисляется при участии дегидрогеназы в высшую жирную кислоту, и процесс повторяется снова (рис. 9.2). Однако этот путь не может обеспечить полного окисления. Он используется лишь для укорочения цепей жирных кислот, а также в качестве обходного пути, когда b-окисление оказывается заблокированным из-за присутствия боковых метильных групп. Процесс не требует участия СоА и не сопровождается образованием АТР.
Некоторые жирные кислоты могут также подвергаться окислению по w-углеродному атому (w-окисление). В этом случае СН 3 - группа подвергается гидроксилированию под действием монооксигеназы, в ходе которого возникает w-оксикислота, которая затем окисляется до дикарбоновой кислоты. Дикарбоновая кислота может укорачиваться с любого конца посредством реакций b-окисления.

Подобным образом в клетках микроорганизмов и некоторых тканей животных происходит расщепление насыщенных углеводородов. На первой стадии с участием молекулярного кислорода происходит гидроксилирование молекулы с образованием спирта, который последовательно окисляется в альдегид и карбоновую кислоту, активируется присоединением СоА и вступает в путь b-окисления.
протекает в печени, почках, скелетных и сердечной мышцах, в жировой ткани. В мозговой ткани скорость окисления жирных кислот весьма незначительна; основным источником энергии в мозговой ткани служит глюкоза.
окисление молекулы жирной кислоты в тканях организма происходит в β-положении. В результате от молекулы жирной кислоты последовательно отщепляются двууглеродные фрагменты со стороны карбоксильной группы.
Жирные кислоты, входящие в состав естественных жиров животных и растений, имеют четное число углеродных атомов. Любая такая кислота, от которой отщепляется по паре углеродных атомов, в конце концов проходит через стадию масляной кислоты. После очередного β-окисления масляная кислота становится ацетоуксусной. Последняя затем гидролизуется до двух молекул уксусной кислоты.
Доставка жирных кислот к месту их окисления – к митохондриям – происходит сложным путем: при участии альбумина осуществляется транспорт жирной кислоты в клетку; при участии специальных белков (fatty acid binding proteins, FABP) – транспорт в пределах цитозоля; при участии карнитина – транспорт жирной кислоты из цитозоля в митохондрии.
Процесс окисления жирных кислот складывается из следующих основных этапов.
Активация жирных кислот . Свободная жирная кислота независимо от длины углеводородной цепи является метаболически инертной и не может подвергаться никаким биохимическим превращениям, в том числе окислению, пока не будет активирована. Активация жирной кислоты протекает на наружной поверхности мембраны митохондрий при участии АТФ, коэнзима A (HS-KoA) и ионов Mg 2+ . Реакция катализируется ферментом ацил-КоА-синтетазой:
В результате реакции образуется ацил-КоА, являющийся активной формой жирной кислоты.
Считают, что активация жирной кислоты протекает в 2 этапа. Сначала жирная кислота реагирует с АТФ с образованием ациладенилата, представляющим собой эфир жирной кислоты и АМФ. Далее сульфгидрильная группа КоА действует на прочно связанный с ферментом ациладенилат с образованием ацил-КоА и АМФ.
Транспорт жирных кислот внутрь митохондрий . Коэнзимная форма жирной кислоты, в равной мере как и свободные жирные кислоты, не обладает способностью проникать внутрь митохондрий, где, собственно, и протекает их окисление. Переносчиком активированных жирных кислот с длинной цепью через внутреннюю митохондриальную мембрану служит карнитин. Ацильная группа переносится с атома серы КоА на гидроксильную группу карнитина с образованием ацилкарнитина, который диффундирует через внутреннюю митохондриальную мембрану:

Реакция протекает при участии специфического цитоплазматического фермента карнитин-ацилтрансферазы. Уже на той стороне мембраны, которая обращена к матриксу, ацильная группа переносится обратно на КоА, что термодинамически выгодно, поскольку О-ацильная связь в кар-нитине обладает высоким потенциалом переноса группы. Иными словами, после прохождения ацилкарнитина через мембрану митохондрий происходит обратная реакция – расщепление ацилкарнитина при участии HS-KoA и митохондриальной карнитин-ацилтрансферазы:

Внутримитохондриальное окислениежирных кислот . Процесс окисления жирной кислоты в митохондриях клетки включает несколько последовательных энзиматических реакций.
Первая стадия дегидрирования. Ацил-КоА в митохондриях прежде всего подвергается ферментативному дегидрированию, при этом ацил-КоА теряет 2 атома водорода в α- и β-положениях, превращаясь в КоА-эфир ненасыщенной кислоты. Таким образом, первой реакцией в каждом цикле распада ацил-КоА является его окисление ацил-КоА-де-гидрогеназой, приводящее к образованию еноил-КоА с двойной связью между С-2 и С-3:

Существует несколько ФАД-содержащих ацил-КоА-дегидрогеназ, каждая из которых обладает специфичностью по отношению к ацил-КоА с определенной длиной углеродной цепи.
Стадия гидратации . Ненасыщенный ацил-КоА (еноил-КоА) при участии фермента еноил-КоА-гидратазы присоединяет молекулу воды. В результате образуется β-оксиацил-КоА (или 3-гидроксиацил-КоА):

Заметим, что гидратация еноил-КоА стереоспецифична, подобно гидратации фумарата и аконитата (см. с. 348). В результате гидратации транс-Δ 2 -двойной связи образуется только L-изомер 3-гидроксиацил-КоА.
Вторая стадия дегидрирования . Образовавшийся β-оксиацил-КоА (3-гидроксиацил-КоА) затем дегидрируется. Эту реакцию катализируют НАД + -зависимые дегидрогеназы:

Тиолазная реакция . В ходе предыдущих реакций происходило окисление метиленовой группы при С-3 в оксогруппу. Тиолазная реакция представляет собой расщепление 3-оксоацил-КоА с помощью тиоловой группы второй молекулы КоА. В результате образуется укороченный на два углеродных атома ацил-КоА и двууглеродный фрагмент в виде ацетил-КоА. Данная реакция катализируется ацетил-КоА-ацилтрансферазой (β-ке-тотиолазой):

Образовавшийся ацетил-КоА подвергается окислению в цикле трикар-боновых кислот, а ацил-КоА, укоротившийся на два углеродных атома, снова многократно проходит весь путь β-окисления вплоть до образования бутирил-КоА (4-углеродное соединение), который в свою очередь окисляется до 2 молекул ацетил-КоА
За один цикл β-окисления образуется 1 молекула ацетил-СоА, окисление которого в цитратном цикле обеспечивает синтез 12 моль ATP . Кроме того, образуется 1 моль FADH 2 и 1 моль NADH+H , при окислении которых в дыхательной цепи синтезируется соответственно 2 и 3 моль ATP (в сумме 5).
Таким образом, при окислении, например, пальмитиновой кислоты (С16) происходит 7 циклов β-окисления, в результате которых образуется 8 моль ацетил-СоА, 7 моль FADH 2 и 7 моль NADH+H. Следовательно, выход ATP составляет 35 молекул в результате β-окисления и 96 ATP в результате цитратного цикла, что соответствует в сумме 131 молекул АТФ.
Окисление жирных кислот может быть патологически повышено или патологически снижено.
Увеличение скорости окисления жирных кислот, особенно при недостатке углеводов происходит:
1. При приеме богатой жирами пище.
2. При голодании.
3. При сахарном диабете.
В этом случае из ацетил-КоА, образующего при β-окислении жирных кислот в печени образуется большое количество кетоновых тел. Накопление кетоновых тел приводит к ацидозу и называется кетоз.
Снижение скорости окисления жирных кислот наблюдается при:
1. Недостатке карнитина. Наблюдается у новорожденных, чаще недоношенных детей. Обусловлено либо нарушением биосинтеза карнитина, либо его «утечкой» в почках.
Симптомы:
· приступы гипогликемии, возникающие из-за снижения глюконеогенеза в результате нарушения процесса окисления жирных кислот;
· уменьшения синтеза кетоновых тел, сопровождающееся повышением содержания свободных жирных кислот в плазме крови;
· миастения (мышечная слабость);
· накопление липидов.
Лечение: прием карнитина внутрь.
2. Снижении активности карнитин-пальмитоилтрансферазы.
В печени приводит к гипогликемии и понижению содержания кетоновых тел в плазме крови.
В мышцах - к нарушению процесса окисления жирных кислот, в результате чего возникает мышечная слабость и развивается миоглобинурия.
3. Дикарбоновой ацидурии.
Основной симптом - экскреция С 6 -С 10 -дикарбоновых кислот и развивается гипогликемия, не связанная с повышением кетоновых тел.
Этиология: отсутствие в митохондриях ацетил-КоА дегидрогеназы среднецепочечных жирных кислот, которые укорачиваются до среднецепочечных дикарбоновых кислот, выводимых из организма.
Возникает у людей после употребления незрелых плодов аки, которые содержат токсин гипоглицин, инактивирующий ацил-КоА-дегидрогеназу, в результате чего ингибируется процесс β-окисления.
5. Синдроме Цельвегера (цереброгепаторенальный синдром).
Является редким наследственным заболеванием, при котором во всех тканях отсутствует пероксисомы. У больных страдающих синдромом Цельвегера, в мозге накапливаются С 26 -С 28 -полиеновые кислоты, т.к. из-за отсутствия пероксисом у них не происходит процесс окисления длинноцепочечных жирных кислот.
6. Болезни Рефсума.
Редкое неврологическое заболевание. Связано с врожденным нарушением системы α-окисления, что приводит к накоплению в тканях фитановой кислоты, которая блокирует систему β-окисления.
Определение уровня общих липидов в плазме (сыворотке) крови по цветной реакции с сульфофосфованилиновым реактивом
Общие липиды - обобщенное понятие, включающее неэстерифицированные жирные кислоты, триглицериды, фосфолипиды, свободный и эстерифицированный холестерин, сфингомиелины.
Принцип метода: продукты распада ненасыщенных липидов образуют с реактивом (состоящим из серной, ортофосфорной кислот и ванилина) соединение, интенсивность окраски которого пропорциональна содержанию общих липидов в сыворотке крови.
Реактивы:
1. Концентрированная серная кислота;
2. Фосфорнованилиновая смесь. 4 объема концентрированной ортофосфорной кислоты смешивают с одним объемом 6 г/л раствора ванилина. Смесь хранят в посуде из темного стекла при комнатной температуре.
3. Эталонный раствор триолеина, 8 г/л.
Ход определения
К 0,02 мл сыворотки крови прибавляют 1,5 мл концентрированной серной кислоты. Содержимое перемешивают и помещают на 15 минут в кипящую водяную баню. После охлаждения гидролизата отмеривают 0,1 мл (контрольная проба 0,1 мл концентрированной серной кислоты), который переносят в другие пробирки, содержащие 1,5 мл фосфорнованилинового реактива. После перемешивания пробы инкубируют 50 минут в темном месте при комнатной температуре. Оптическую плотность пробы (А 1) и эталонного раствора (А 2) измеряют на фотоколориметре при длине волны 510-540 нм в кювете толщиной слоя 10 мм против контрольного раствора. Расчет производят по формуле: .
Нормальное содержание в сыворотке крови: 4 - 8 г/л.
Клинико-диагностическое значение. Изменения содержания в крови количественной и качественной составляющей данного показателя наблюдаются при многих заболеваниях и патологических состояниях, которые не рассматриваются в данном пособии. Применительно к мышечной деятельности наблюдается увеличение данного показателя после продолжительной физической нагрузки, что показывает степень включения липидного обмена в энергетическое обеспечение мышечной деятельности. При этом величина данного показателя обычно не выходит за референтные пределы. Более информативным является определение динамики сдвигов при физической нагрузке, составляющих данного показателя.
БИОСИНТЕЗ ЛИПИДОВ
Биосинтез липидов (липогенез) необходим для создания запасных форм. Биосинтез липидов начинается с биосинтеза жирных кислот.
Биосинтез жирных кислот
Система синтеза жирных кислот находится в растворимой цитоплазматической фракции многих органов и тканей, таких какпечень, почки, молочная железа, жировая ткань.
Биосинтез жирных кислот протекает с участием:
1. НАДФН∙Н + ;
5. ацетил-КоА в качестве субстрата и пальмитиновая кислота в качестве конечного продукта.
Особенности биосинтеза жирных кислот
Синтез жирных кислот не является простым обращением реакций β-окисления. Наиболее важными особенностями являются следующие:
1. Синтез жирных кислот протекает в цитоплазме, в отличие от распада который протекает в митохондриях.
2. Промежуточные продукты синтеза жирных кислот ковалентно связаны с сульфгидрильными группами ацилпереносящего белка (АПБ).
3. Многие ферменты синтеза жирных кислот у высших организмов и человека организованы в мультиферментный комплекс, называемый синтетазой жирных кислот.
4. Непосредственно ацетил-КоА используется только как затравка.
5. Растущая цепь жирной кислоты удлиняется путем непосредственного присоединения двухуглеродных компонентов, происходящих из ацетил-КоА. Активированным донором двухуглеродных компонентов на стадии элонгации служит малонил-КоА. Реакция элонгации запускается высвобождением СО 2 .
6. Роль восстановителя при синтезе жирной кислоты выполняет НАДФН·Н + .
7. Синтез жирной кислоты является циклическим процессом протекающим на поверхности синтетазы жирных кислот.
8. Элонгация под действием комплекса синтетазы жирных кислот останавливается на этапе образования пальмитата (С 16). Дальнейшая элонгация и введение двойных связей осуществляется другими ферментными системами.
Этапы биосинтеза жирных кислот
I этап - транспорт ацетил-КоА из митохондрий в цитоплазму
Жирные кислоты синтезируются в цитоплазме, а ацетил-КоА образуется из пирувата в митохондриях. Мембрана митохондрий не проницаема для ацетил-КоА, поэтому транспорт ацетил-КоА через мембрану обеспечивается специальными механизмами. Роль карнитина в транспорте ацетил-КоА не велика, так как он переносит только длинноцепочечные жирные кислоты. Данная проблема решается путем синтеза цитрата.
Митохондрия Цитоплазма
Ацетил-КоА + оксалоацетат ацетил-КоА + оксалоацетат + АДФ + Ф н
НО - С - СООН цитрат + АТФ + HSKoA
СН 2 - СООН
Рис. 20. Схема транспорта ацетил-КоА через мембрану митохондрий
Цитрат образуется в митохондриальном матриксе путем конденсации ацетил-КоА и оксалоацетата. Затем диффундирует в цитоплазму, где расщепляется цитратлиазой. Таким образом, ацетил-КоА и оксалоацетат переносятся из митохондрий в цитоплазму с использованием одной молекулы АТФ.
Источники НАДФН·Н + для биосинтеза жирных кислот
Оксалоацетат, образовавшийся в результате переноса ацетил-КоА в цитоплазму должен быть возвращен обратно в митохондрию. Данный процесс сопряжен с генерацией НАДФН·Н + . Реакция происходит в цитоплазме и протекает в 2 этапа:
1. Оксалоацетат + НАДН·Н + Малат + НАД +
МДГ (декарбоксилирующая)
2. Малат + НАДФ + Пируват + СО 2 + НАДФН·Н +
Образовавшийся пируват легко диффундирует в митохондрии, где он карбоксилируется в оксалоацетат под действием пируваткарбоксилазы (с затратой энергии АТФ).
Пируват + НСО 3 - + АТФ Оксалоацетат + АДФ + Ф н
Нормальное окисление жиров в организме тесно связано с циклом Кребса. Основной путь образования оксалоацетата - карбоксилирование ПВК. Для сгорания 1,5 г жирных кислот, требуется 1 г углеводов. Отсюда, среди биохимиков есть поговорка, что «жиры сгорают в пламени углеводов».
Оксалоацетат, который синтезировался в данной реакции, затем взаимодействует с ацетил-КоА с образованием цитрата, который окисляется в ЦТК.
Таким образом, на каждую молекулу ацетил-КоА, которая переходит из митохондрий в цитоплазму, образуется одна молекула НАДФН·Н + . Следовательно, при переходе 8 молекул ацетил-КоА необходимых для синтеза пальмитиновой кислоты, образуется 8 молекул НАДФН·Н + . Еще 6 молекул требуемых для этого процесса генерируются в пентозофосфатном пути.
II этап - образование малонил-КоА.
Является первой реакцией биосинтеза жирных кислот. Катализируется ферментом ацетил-КоА-карбоксилазой. Коферментом является биотин. Реакция заключается в карбоксилилировании ацетил-КоА, источником СО2 является бикарбонат.
C = O + HCO 3 - + АТФ Е– биотин CН 2 + АДФ+H 3 PO 4
ацетил - KоA малонил - KоA
Рис. 21. Карбоксилирование ацетил-КоА (коферментом ацетил-КоА-карбоксилазы является биотин)
Малонил-КоА, по сути, является активированным ацетил-КоА. Энергия запасается заранее в виде карбоксильной группы и освобождается при декарбоксилировании непосредственно при биосинтезе жирных кислот. В дальнейшем биосинтезе жирных кислот ацетил-КоА используется как затравка, а непосредственно синтез идет из малонил-КоА.
III этап - биосинтез жирных кислот.
Процесс окисления жирных кислот складывается из следующих основных этапов.
Активация жирных кислот. Свободная жирная кислота независимо от длины углеводородной цепи является метаболически инертной и не может подвергаться никаким биохимическим превращениям, в том числе окислению, пока не будет активирована. Активация жирной кислоты протекает на наружной поверхности мембраны митохондрий при участии АТФ, коэнзима A (HS-KoA) и ионов Mg 2+ . Реакция катализируется ферментом ацил-КоА-синтетазой:
В результате реакции образуется ацил-КоА, являющийся активной формой жирной кислоты.
Первая стадия дегидрирования. Ацил-КоА в митохондриях прежде всего подвергается ферментативному дегидрированию, при этом ацил-КоА теряет 2 атома водорода в α- и β-положениях, превращаясь в КоА-эфир ненасыщенной кислоты.

Стадия гидратации. Ненасыщенный ацил-КоА (еноил-КоА) при участии фермента еноил-КоА-гидратазы присоединяет молекулу воды. В результате образуется β-оксиацил-КоА (или 3-гидроксиацил-КоА):

Вторая стадия дегидрирования. Образовавшийся β-оксиацил-КоА (3-гидроксиацил-КоА) затем дегидрируется. Эту реакциюкатализируют НАД + -зависимые дегидрогеназы:

Тиолазная реакция. представляет собой расщепление 3-оксоацил-КоА с помощью тиоловой группы второй молекулы КоА. В результате образуется укороченный на два углеродных атома ацил-КоА и двууглеродный фрагмент в виде ацетил-КоА. Данная реакция катализируется ацетил-КоА-ацилтрансферазой (β-ке-тотиолазой):

Образовавшийся ацетил-КоА подвергается окислению в цикле трикар-боновых кислот, а ацил-КоА, укоротившийся на два углеродных атома, снова многократно проходит весь путь β-окисления вплоть до образования бутирил-КоА (4-углеродное соединение), который в свою очередь окисляется до 2 молекул ацетил-КоА.
Баланс энергии. При каждом цикле β-окисления образуются одна молекула ФАДН 2 и одна молекула НАДН. Последние в процессеокисления в дыхательной цепи и сопряженного с ним фосфорилирования дают: ФАДН 2 – 2 молекулы АТФ и НАДН – 3 молекулы АТФ, т.е. в сумме за один цикл образуется 5 молекул АТФ. При окислении пальмитиновой кислоты образуется 5 х 7 = 35 молекул АТФ. В процессе β-окисления пальмитиновой кислоты образуется 8 молекул ацетил-КоА, каждая из которых, «сгорая» в цикле трикарбоновых кислот, дает 12 молекул АТФ, а 8 молекул ацетил-КоА дадут 12 х 8 = 96 молекул АТФ.
Таким образом, всего при полном β-окислении пальмитиновой кислоты образуется 35 + 96 = 131 молекула АТФ. С учетом одноймолекулы АТФ, потраченной в самом начале на образование активной формы пальмитиновой кислоты (пальмитоил-КоА), общий энергетический выход при полном окислении одной молекулы пальмитиновой кислоты в условиях животного организма составит 131 – 1 = 130 молекул АТФ.